La molécule de dioxyde de carbone est linéaire. A l'état fondamental, les deux liaisons carbone-oxygène sont de même longueur; le moment dipolaire de cette molécule est alors nul. Cependant,
ces deux liaisons carbone-oxygène peuvent vibrer ce qui permet à la molécule d'atteindre des états d'énergie de vibration différents.
On distingue quatre modes de vibration:| Vibrations élongation | Vibrations de déformation angle | ||
 |  |  |  |
| symétrique | antisymétrique | dans le plan | en dehors du plan |
- les vibrations d'élongation symétriques où l'atome de carbone est entraîné vers l'un et l'autre atome d'oxygène;
- les vibrations d'élongation antisymétriques où les deux atomes d'oxygène ont des mouvements dans le même sens contrairement au mouvement de l'atome de carbone;
- les vibrations de déformation d'angle dans le plan où les deux atomes d'oxygène ont des mouvements dans le même sens contrairement à l'atome de carbone; les liaisons ne sont plus alors parallèles;
- les vibrations de déformation d'angle hors du plan (même description que ci-dessus mais hors du plan).
Spectre infrarouge du dioxyde de carbone
Un mode de vibration est actif en IR si le moment dipolaire de la molécule varie lors des vibrations. Ce n'est pas le cas pour la vibration symétrique d'élongation, où le moment dipolaire reste nul pour des raisons de symétrie. C'est le cas pour la vibrations d'élongation asymétrique ainsi que pour les vibrations de déformation d'angle.
C'est pendant ces vibrations que la molécule absorbe de l'énergie dans l'infrarouge et
réémet cette énergie dans tous les sens en retombant sur son état fondamental.
Le spectre d'absorption IR du dioxyde de carbone fait voir des bandes correspondant à une absorption d'énergie. On distingue trois bandes:
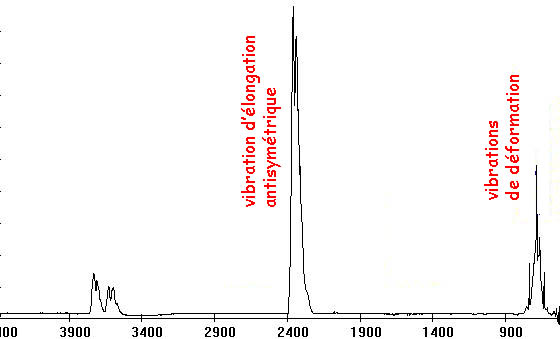

- à une fréquence de 2349 cm -1, ce qui correspond aux vibrations d'élongation antisymétriques;
- à une fréquence de 667 cm -1, ce qui correspond aux vibrations de déformation d'angle dans le plan.